Page 30 - OHKF_Biotech_2021_SC
P. 30
4
• 港深生物科技合作生态系统构想
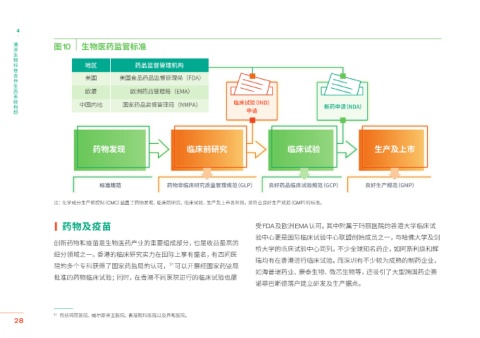
图10 生物医药监管标准
地区 药品监督管理机构
美国 美国食品药品监督管理局(FDA)
欧盟 欧洲药品管理局(EMA)
临床试验(IND)
中国内地 国家药品监督管理局(NMPA) 新药申请(NDA)
申请
药物发现 临床前研究 临床试验 生产及上市
标准规范 药物非临床研究质量管理规范(GLP) 良好药品临床试验规范(GCP) 良好生产规范(GMP)
注:化学成分生产和控制(CMC)涵盖了药物发现、临床前研究、临床试验、生产及上市各阶段,须符合良好生产规范(GMP)的标准。
| 药物及疫苗 受FDA及欧洲EMA认可。其中附属于玛丽医院的香港大学临床试
验中心更是国际临床试验中心联盟创始成员之一,与哈佛大学及剑
创新药物和疫苗是生物医药产业的重要组成部分,也是收益最高的
桥大学的临床试验中心同列。不少全球知名药企,如阿斯利康和辉
细分领域之一。香港的临床研究实力在国际上享有盛名,有四间医
瑞均有在香港进行临床试验。而深圳有不少较为成熟的制药企业,
31
院的多个专科获得了国家药监局的认可, 可以开展经国家药监局
如海普瑞药业、康泰生物、微芯生物等,还吸引了大型跨国药企赛
批准的药物临床试验;同时,在香港不同医院进行的临床试验也屡
诺菲巴斯德落户建立研发及生产据点。
31 包括玛丽医院、威尔斯亲王医院、香港眼科医院以及养和医院。
28