Page 31 - OHKF_Biotech_2021_SC
P. 31
为发挥两地在药物研发领域的优势,相关政府部门可积极吸引或鼓
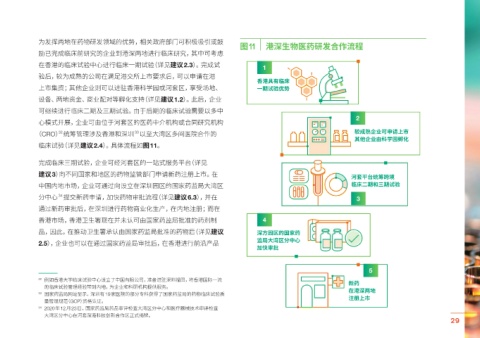
图11 港深生物医药研发合作流程
励已完成临床前研究的企业到港深两地进行临床研究,其中可考虑
在香港的临床试验中心进行临床一期试验(详见建议2.3)。完成试 1
验后,较为成熟的公司在满足港交所上市要求后,可以申请在港
香港具有临床
上市集资;其他企业则可以进驻香港科学园或河套区,享受场地、 一期试验优势
设备、两地资金、商业配对等孵化支持(详见建议1.2)。此后,企业
可继续进行临床二期及三期试验。由于后期的临床试验需要以多中
2
心模式开展,企业可由位于河套区的医药中介机构或合同研究机构
33
(CRO) 统筹管理涉及香港和深圳 以至大湾区多间医院合作的 较成熟企业可申请上市
32
其他企业由科学园孵化
临床试验(详见建议2.4)。具体流程如图11。
完成临床三期试验,企业可经河套区的一站式服务平台(详见
建议3)向不同国家和地区的药物监管部门申请新药注册上市。在 河套平台统筹跨境
中国内地市场,企业可通过向设立在深圳园区的国家药监局大湾区 临床二期和三期试验
34
分中心 提交新药申请,加快药物审批流程(详见建议6.3),并在 3
通过新药审批后,在深圳进行药物商业化生产,在内地注册;而在
香港市场,香港卫生署现在并未认可由国家药监局批准的药剂制 4
品,因此,在推动卫生署承认由国家药监局批准的药物后(详见建议 深方园区的国家药
监局大湾区分中心
2.5),企业也可以在通过国家药监局审批后,在香港进行前沿产品
加快审批
5
32
例如香港大学临床试验中心设立了中国有限公司,准备进驻深圳福田,将香港国际一流
新药
的临床试验管理经验带到内地,为企业和科研机构提供服务。
33 在港深两地
国家药监局网站显示,深圳有19家医院的部分专科获得了国家药监局的药物临床试验质
注册上市
量管理规范(GCP)资格认证。
34
2020年12月23日,国家药监局药品审评检查大湾区分中心和医疗器械技术审评检查
大湾区分中心在河套深港科技创新合作区正式揭牌。
29