Page 31 - OHKF_Biotech_2021_TC
P. 31
為發揮兩地在藥物研發領域的優勢,相關政府部門可積極吸引或
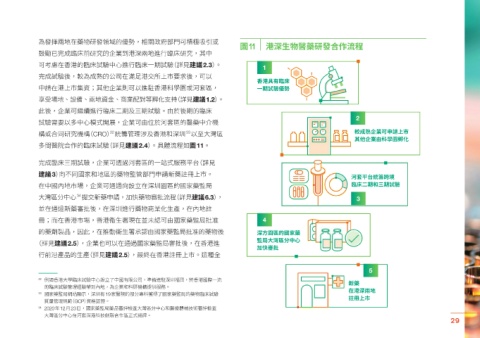
圖11 港深生物醫藥研發合作流程
鼓勵已完成臨床前研究的企業到港深兩地進行臨床研究,其中
可考慮在香港的臨床試驗中心進行臨床一期試驗(詳見建議2.3)。 1
完成試驗後,較為成熟的公司在滿足港交所上市要求後,可以
香港具有臨床
申請在港上市集資;其他企業則可以進駐香港科學園或河套區, 一期試驗優勢
享受場地、設備、兩地資金、商業配對等孵化支持(詳見建議1.2)。
此後,企業可繼續進行臨床二期及三期試驗。由於後期的臨床
2
試驗需要以多中心模式開展,企業可由位於河套區的醫藥中介機
32 33 較成熟企業可申請上市
構或合同研究機構(CRO) 統籌管理涉及香港和深圳 以至大灣區
其他企業由科學園孵化
多間醫院合作的臨床試驗(詳見建議2.4)。具體流程如圖11。
完成臨床三期試驗,企業可透過河套區的一站式服務平台(詳見
建議3)向不同國家和地區的藥物監管部門申請新藥註冊上市。
河套平台統籌跨境
在中國內地市場,企業可通過向設立在深圳園區的國家藥監局 臨床二期和三期試驗
34
大灣區分中心 提交新藥申請,加快藥物審批流程(詳見建議6.3), 3
並在通過新藥審批後,在深圳進行藥物商業化生產,在內地註
冊;而在香港市場,香港衞生署現在並未認可由國家藥監局批准 4
的藥劑製品,因此,在推動衞生署承認由國家藥監局批准的藥物後 深方園區的國家藥
監局大灣區分中心
(詳見建議2.5),企業也可以在通過國家藥監局審批後,在香港進
加快審批
行前沿產品的生產(詳見建議2.5),最終在香港註冊上市。這種全
5
32
例如香港大學臨床試驗中心設立了中國有限公司,準備進駐深圳福田,將香港國際一流
新藥
的臨床試驗管理經驗帶到內地,為企業和科研機構提供服務。
33 在港深兩地
國家藥監局網站顯示,深圳有19家醫院的部分專科獲得了國家藥監局的藥物臨床試驗
註冊上市
質量管理規範(GCP)資格認證。
34
2020年12月23日,國家藥監局藥品審評檢查大灣區分中心和醫療器械技術審評檢查
大灣區分中心在河套深港科技創新合作區正式揭牌。
29