Page 52 - OHKF_Biotech_2021_SC
P. 52
5
• 供港深两地政府参考的政策建议
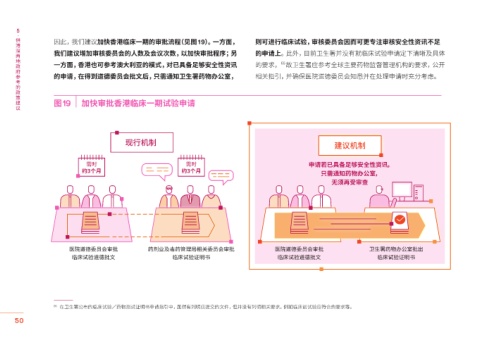
因此,我们建议加快香港临床一期的审批流程(见图19)。一方面, 则可进行临床试验,审核委员会因而可更专注审核安全性资讯不足
我们建议增加审核委员会的人数及会议次数,以加快审批程序;另 的申请上。此外,目前卫生署并没有就临床试验申请定下清晰及具体
65
一方面,香港也可参考澳大利亚的模式,对已具备足够安全性资讯 的要求, 故卫生署应参考全球主要药物监督管理机构的要求,公开
的申请,在得到道德委员会批文后,只需通知卫生署药物办公室, 相关指引,并确保医院道德委员会知悉并在处理申请时充分考虑。
图19 加快审批香港临床一期试验申请
现行机制
建议机制
需时 需时 申请若已具备足够安全性资讯,
约�个月 约�个月
只需通知药物办公室,
无须再受审查
医院道德委员会审批 药剂业及毒药管理局相关委员会审批 医院道德委员会审批 卫生署药物办公室批出
临床试验道德批文 临床试验证明书 临床试验道德批文 临床试验证明书
65
在卫生署公布的临床试验/药物测试证明书申请指引中,虽然有列明应提交的文件,但并没有列明相关要求,例如临床前试验应符合的要求等。
50